BPASSP1ère Ch1 - Comprendre les avantages et les inconvénients de la combustion du carbone et des hydrocarbures
THERMIQUE
Ajouter à mes favoris
Thermique : comment utiliser et contrôler les transferts thermiques ?
|
Capacités
|
Connaissances
|
| Réaliser expérimentalement une réaction de combustion de charbon ou d'un hydrocarbure et identifier les produits de la combustion. Calculer l'énergie libérée sous forme d'énergie thermique par la combustion d'une masse donnée d'hydrocarbure à partir des données fournies. Écrire et ajuster l'équation de la réaction modélisant la combustion d'un hydrocarbure. Déterminer la masse de dioxyde de carbone (CO2) dégagée par la combustion complète d'une masse donnée d'un hydrocarbure, à partir des données fournies. | Connaître les produits de la combustion complète ou incomplète d'un hydrocarbure dans l'air. Connaître la dangerosité des composés lors d'une combustion incomplète. Savoir que la combustion d'un hydrocarbure ou du charbon libère de l'énergie thermique. Savoir que l'énergie utilisée aujourd'hui est très majoritairement obtenue à l'aide de combustions de ce type. Savoir que le dioxyde de carbone est l'un des principaux gaz à effet de serre et que l'augmentation de sa concentration dans l'atmosphère accentue le réchauffement climatique. - Savoir que les moteurs thermiques convertissent l'énergie libérée par la combustion en énergie mécanique. |
"Je me positionne " en appliquant la (ou les) bonne(s) réponse(s)
| 1/. L'unité de température est : a - degré Celsius b - Kelvin c - degré Fahrenheit | 2/. La température se relève à l'aide : a - d'un baromètre b - d'un thermomètre c - d'un joulemètre |
| 3/. 20°C est équivalent à : a - 293,15 K b - 253,15 K c - -20 K | 4/. 30K est équivalent à : a - -243,15°C b - 303,15°C c - 30°C |
| 5/. L'eau salée gelée à une température : a - négative b - égale à 0 c - positive | 6/. De l'énergie peut être transportée par : a - la température b - la chaleur c - le thermomètre |
| 7/. L'échelle de température utilisée dans les calculs scientifiques est l'échelle : a - Celsius b - Fahrenheit c - Kelvin | 8/. Lors d'un changement d'état de la température d'un corps pur : a - augmenter b - ne varie pas c - diminuer |
1ère partie
I - Etude de l'impact d'une combustion sur l'environnement
- Démarche d'enquête page 15
Problématique : L'utilisation du charbon de bois des barbecues classiques a-t-il un impact néfaste sur l'environnement ?
Le barbecue au charbon utilise les phénomènes de combustion.
Cette réaction chimique a pour produit le dioxyde de carbone CO2 . Celui ci est un gaz à effet de serre et est donc nocif pour l'environnement.
II - Etude de la combustion des hydrocarbures
a ) un hydrocarbure
Définition : Un hydrocarbure est un ............................................ .................................. contenant exclusivement des atomes de .......... . ........................ et d'................................. ............, récupéré sous forme ...................... (dans le gaz naturel), ..... ................... (dans le pétrole) ou ............................... ( dans le charbon).
b ) Réaliser la combustion de charbon ou d'un hydrocarbure et identifier les produits
Combustion complète du méthane
quelles sont les réactifs ? .................. et .......................
Quels sont les produits formés lors de la combustion ?
.......................................
........................................
Combustion incomplète du butane
Quels sont les produits formés lors de la combustion ?
...................................... .............. ........................
........................................ ........ .......................
CV
A noter qu'il existe 2 types de combustions :
- la combustion complète (flamme bleue) lorsque le dioxygène est en quantité suffisante, les réactifs étant un hydrocarbure et du dioxygène.
il se forme alors, du dioxyde de carbone et de l'eau
|
une équation de combustion complète est toujours de la forme : Hydrocarbure + Dioxygène --> Dioxyde de carbone + eau |
- la
combustion incomplète
(flamme jaune) lorsque le dioxygène est en quantité insuffisante
il se forme alors, du carbone, du dioxyde de carbone, du monoxyde de carbone et de l'eau
|
une équation de combustion incomplète est toujours de la forme : Hydrocarbure + Dioxygène --> Carbone + (Monoxyde de carbone et Dioxyde de carbone en quantité variable) + eau |
Le monoxyde de carbone CO est un composé très dangereux car totalement inodore et incolore.
Les fumées noires de Carbone sont nocives en cas d'inhalation.
c) Écrire et équilibrer l'équation d'une réaction de combustion
Les lignes rouges précédentes sont appelées ………………………………………….
Par convention, on symbolise une réaction chimique par une ………………. On appelle « ………………………… » les composés qui interviennent dans la réaction (dans le cas ci-dessus les ………………………… sont l'hydrocarbure et le dioxygène) et on appelle « ………………………… » les composés formés après la réaction.
Une réaction chimique est un processus avec réarrangement des atomes constitutifs des …………………… pour donner de nouveaux corps appelés ……………………. Tous les atomes constitutifs des réactifs se retrouvent dans au moins un des produits, et dans les mêmes quantités. On dit qu'au cours d'une réaction chimique il ya conservation de …………………….
Lors d'une réaction de combustion, il est nécessaire de placer des coefficients stoechiométriques devant certains réactifs ou produits pour que le principe de conservation de la matière s'applique
En équilibre comme suit :
|
- les atomes de carbone
relèvent le nombre d'atomes de carbone dans les réactifs déterminant le nombre à positionner devant la formule contenant du carbone dans les produits |
|
- les atomes d'hydrogène
relèvent le nombre d'atomes d'hydrogène dans les réactifs déterminant le nombre a positionner devant la formule contenant de l'hydrogène dans les produits |
|
calculer
le nombre d'atomes d'oxygène dans les produits
déterminer le nombre à positionner devant la formule du dioxygène des réactifs afin d'obtenir le même nombre |
Conservation de la quantité de matière, des charges et des éléments :
Au cours d'une réaction chimique il y a conservation de la quantité de matière, des charges et des éléments :
1) Conservation de la quantité de matière :
Dans l'écriture d'une équation bilan d'une réaction chimique, les formules chimiques des réactifs et des produits représentent :
- à l'échelle atomique : les molécules ou les atomes en présence.
- à l'échelle humaine : les moles de molécules ou d'atomes des corps en réaction.
Après avoir équilibré la réaction suivante, complétez le tableau.
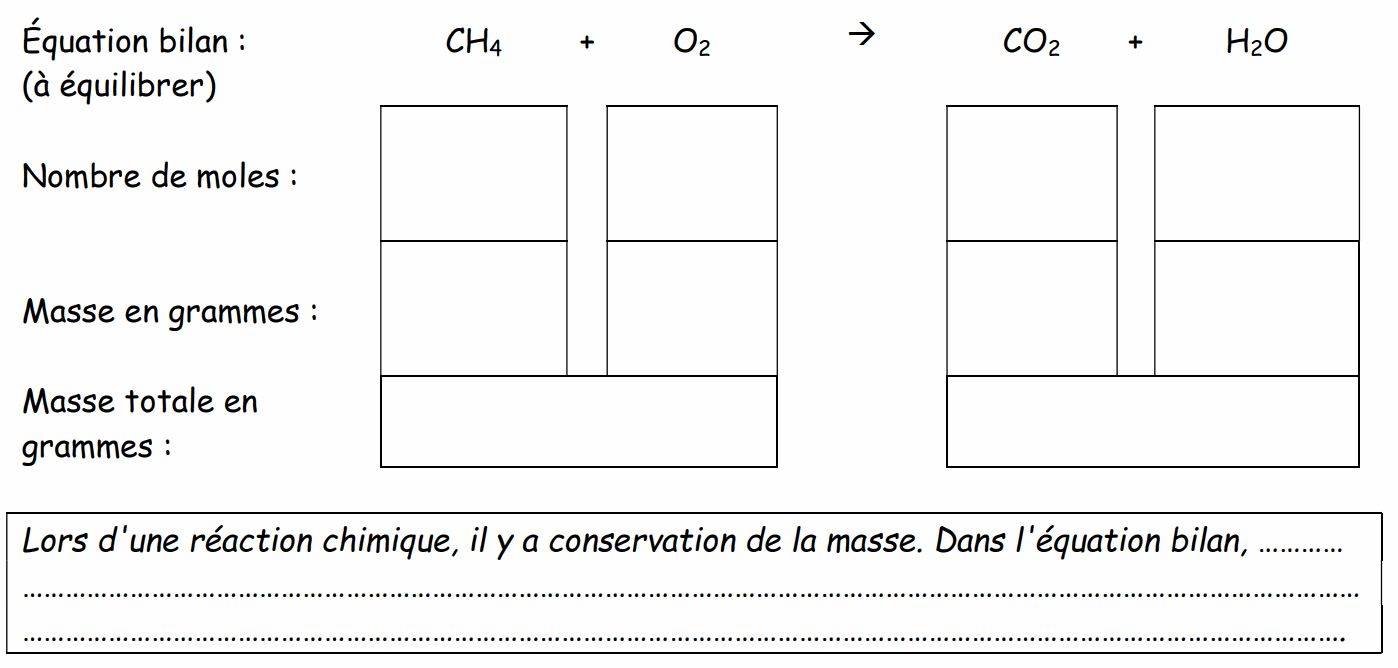
2) Conservation des charges :
Exercice : Certaines réactions suivantes donnent lieu à la présence d'ions.
Il convient donc d'équilibrer les charges de la même manière que l'on équilibrerait les atomes.
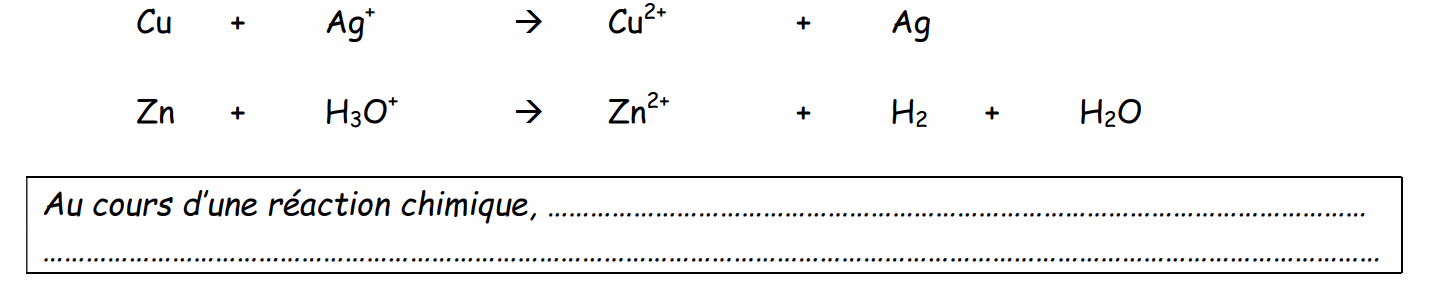
Soit la réaction dont l'équation bilan s'écrit :
C + 2 PbO ----> 2 Pb + CO2 .
Complétez les phrases :
Si 1 mole de C réagit avec …… moles de PbO, il se forme …… moles de Pb et …… mole de CO2.
Si ………… mole de C réagit avec 0,5 moles de PbO, il se forme ………… moles de Pb et ………… moles de CO2.
Si ………… moles de C réagit avec ………… moles de PbO, il se forme 4 moles de Pb et ………… moles de CO2.
2ième partie
Énergie Thermique de combustion :
Combustion d'un hydrocarbure : quels aspects énergétiques ?
Les hydrocarbures sont une source d'énergie importante obtenue par leur combustion (chauffage au fioul, à gaz, moteur thermique, etc...), par exemple, la combustion d'1 Kg de propane à un pouvoir calorifique de 46,6mégajoules, libère 46,6 mégajoules d'énergie
exemple : Ecrire l'équation de la combustion du propane (voir activité 3 page 17)
........................ + ....................... .. -----> .......................... + ................ .....
1) Calcul de l'énergie fournie lors d'une réaction de combustion :
La combustion est donc une réaction chimique au cours de laquelle les réactifs disparaissent pour laisser apparaître de nouveaux corps, les produits de la réaction. Certaines réactions chimiques sont ……………………………………, c'est à dire qu'elles produisent de la chaleur. (Dans une réaction chimique ……………………………………, l'énergie dégagée par la formation de liaisons dans les produits est supérieure à l'énergie requise pour briser les liaisons dans les réactifs. Le contraire d 'une réaction …………………………………… est une réaction ……………………………………, la température baisse au cours d'une telle réaction.)
Il est possible de calculer la quantité d'énergie fournie lors d'une réaction chimique exothermique. Le tableau suivant indique la quantité d'énergie correspondante à la destruction ou à la fabrication de certaines liaisons.

2) Énergie Thermique de combustion :
La combustion du carbone ou des hydrocarbures libère une énergie thermique E (en joule) qui est ………………………………… à la masse m de carbone ou d'hydrocarbure (en kilogramme).
Le coefficient de proportionnalité est appelé ………………………………………………………… (ou chaleur de combustion) (en J/kg). Il dépend de l'hydrocarbure comme l'indique le tableau ci-dessous.
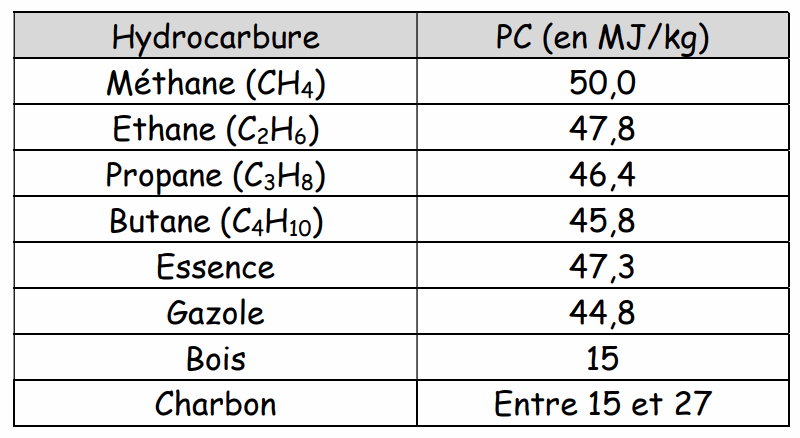
L'énergie thermique pour une masse m de combustible se calcule :
E = mx PC
E en J, m en kg et PC en J/kg
3) Calcul de la quantité de CO2 émise lors d'une réaction de combustion :
Le dioxyde de carbone émis lors des réactions de combustion est l'un des principaux gaz à effet de serre. Ces gaz bloquent et réfléchissent le rayonnement thermique infrarouge.
Application :
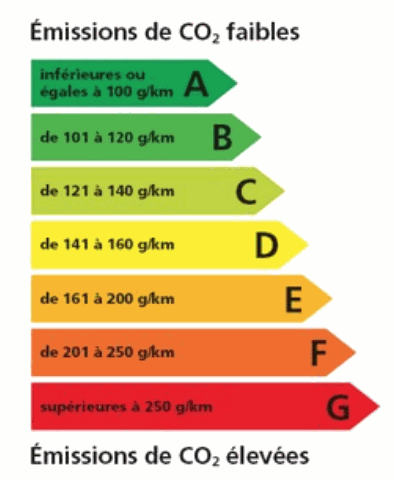
Une voiture dont la consommation d'essence est de 7 L pour 100 km libère du CO2 dans l'atmosphère. On veut déterminer la masse de CO2 produite par km afin de déduire la classe énergétique de la voiture.
On suppose que l’essence utilisée est de l’octane. La masse volumique de l'essence est essence = 750 g/L.
On sait que M(H) = 1 g/mol, M(C) = 12 g/mol et M(O) = 16 g/mol.
Le tableau de classification énergétique est le suivant :
a) Déterminer la quantité de matière de combustible consommée par km.
Pour cela on calcule : Le volume d'essence pour 1 km sera de ………………………………………………………… L.
La masse d'essence correspondante sera de ………………………………………………………………g.
La masse molaire moléculaire de l'octane sera M(C8H18) = ………………………………………………................. .................................. .................. ............................ g/mol.
La quantité de matière sera alors :
|
Moulin de C8H18
|
1 |
|
|
Masse de C8H18 (en g)
|
|
|
b) Écrire l'équation équilibrée de la combustion de l'octane dans le dioxygène.
C8H18 + ………………O2 ------> …………CO2 + …………H2O
c) Compléter l'égalité de formation du CO2 .
1 mole d'octane produit …….... moles de CO2 donc …………mole d'octane produit ………………………… moles de dioxyde de carbone.
d) Calculer la masse de CO2 produite pour 1 km
La masse molaire moléculaire du dioxyde de carbone sera M(CO2) = ……………………………………… ………………………… …………………………… …………………g/mol.
|
Mole de CO2
|
1 |
|
|
Masse de CO2 (en g)
|
|
|
e) Indiquer la classe énergétique de la voiture. La classe énergétique de la voiture est …….

Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.