ES1AB Un niveau d'organisation : Les éléments chimiques
THEME 1
Ajouter à mes favoris
1.1 - Un niveau d'organisation : les éléments chimiques
Comment, à partir du seul élément hydrogène, la diversité des éléments chimiques est-elle apparue ? Aborder cette question nécessite de s'intéresser aux noyaux atomiques et à leurs transformations. Cela fournit l'occasion d'introduire un modèle mathématique d'évolution discrète.
| Savoirs | Savoir-faire |
| Les noyaux des atomes de la centaine d'éléments chimiques stables résultant de réactions nucléaires qui se produisent au sein des étoiles à partir de l'hydrogène initial. La matière connue de l'Univers est formée principalement d'hydrogène et d'hélium alors que la Terre est surtout constituée d'oxygène, d'hydrogène, de fer, de silicium, de magnésium et les êtres vivants de carbone, hydrogène, oxygène et azote. | Produire et analyser différentes représentations graphiques de l'abondance des éléments chimiques (proportions) dans l'Univers, la Terre, les êtres vivants. L'équation d'une réaction nucléaire stellaire étant fournie, reconnaît si celle-ci relève d'une fusion ou d'une fission. |
| Certains noyaux sont instables et se désintègrent (radioactivité). L'instant de désintégration d'un noyau radioactif individuel est aléatoire. La demi-vie d'un noyau radioactif est la durée nécessaire pour que la moitié des noyaux initialement présents dans un échantillon macroscopique se soit désintégrée. Cette demi-vie est une caractéristique du noyau radioactif. | Calculer le nombre de noyaux restants au bout de n demi-vies Estimer la durée nécessaire pour obtenir une certaine proportion de noyaux restants. Utiliser une représentation graphique pour déterminer une demi-vie. Utiliser une décroissance radioactive pour une datation (exemple du carbone 14). |
| Prérequis et limites
Les notions, déjà connues, de noyaux, d'atome, d'élément chimique et de réaction nucléaire sont remobilisées. Aucune connaissance n'est exigible sur les différents types de radioactivité.
L'évolution du nombre moyen de noyaux restants au cours d'une désintégration radioactive se limite au cas de durées discrètes, multiples entières de la demi-vie. Aucun formalisme sur la notion de suite n'est exigible. Les fonctions exponentielle et logarithme ne font pas partie des connaissances attendues |
A - La diversité des éléments chimiques
Depuis la naissance de l'univers, les atomes d'hydrogène qui les composaient majoritairement se sont organisés en systèmes de plus en plus complexes.
Aujourd'hui, les proportions en éléments chimiques de ces systèmes sont très diverses.
La composition chimique moyenne de l'univers est la suivante :
- hydrogène 74%
- helium 24%
- autres 2%
La composition chimique moyenne de la terre est la suivante :
oxygène 30%
fer 32%
silicium 15%
magnésium 14%
souffre 3%
autres 6%
La composition chimique moyenne d'un être humain est la suivante:
oxygène 65%
carbone 18%
hydrogène 10%
azote 3%
calcium 1,5%
autres %
La composition chimique moyenne d'une algue est la suivante :
oxygène 78%
carbone 11%
hydrogène 9%
azote 1%
autres 1%
B - L'origine des éléments chimiques
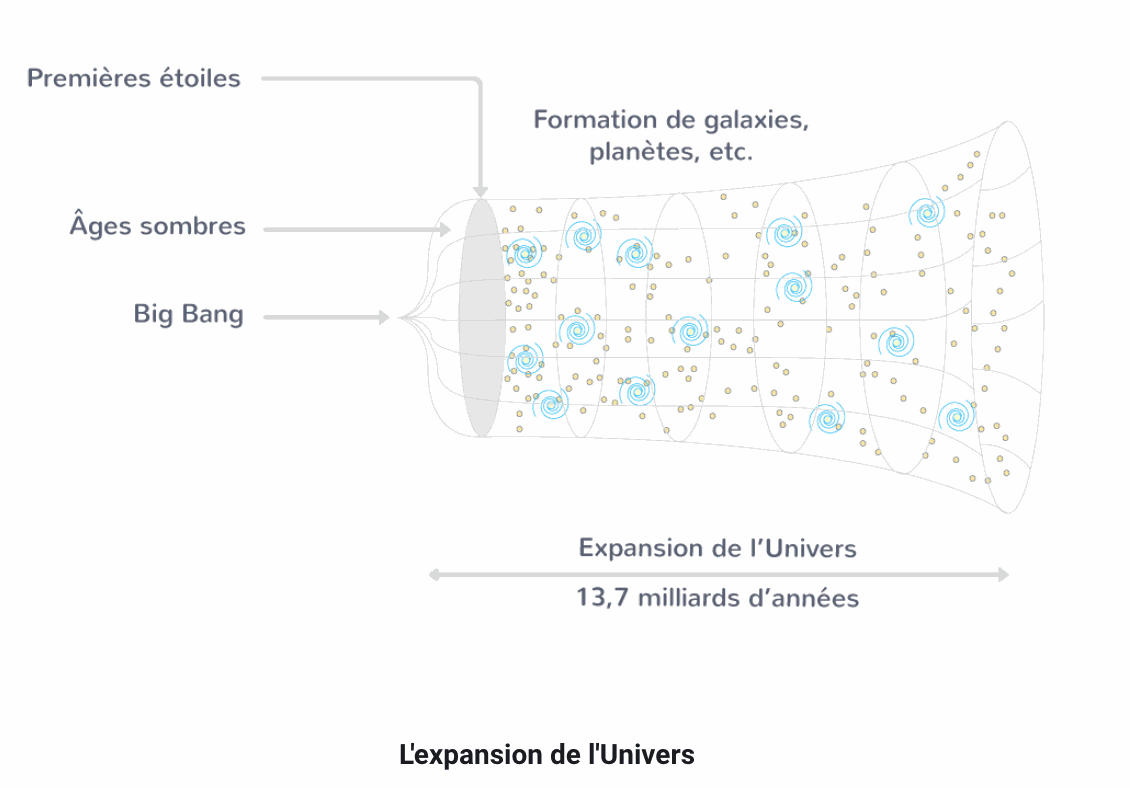
Le modèle du Big Bang permet de décrire l'origine de certains éléments chimiques à partir desquels de nouveaux éléments ont été créés dans le coeur des étoiles.
1 Le big Bang
L'univers n'a pas toujours été tel que nous le connaissons. le modèle du big bang décrit sa naissance et son évolution.
Définition Big Bang
Le Big Bang est une théorie qui, à partir de preuves contemporaines, décrit la naissance de l'univers survenue il y a environ 13,7 milliards d'années.
Dans le modèle du big bang, l'univers originel, qui se résumait à un point très dense et chaud, est rentré en expansion. La matière s'est alors organisée au fur et à mesure du refroidissement de l'univers :
Les premiers noyaux, principalement d'hydrogène et d'hélium, se sont formés pendant les 300 000 premières années.
Les plus anciennes étoiles et galaxies se sont formées quelques centaine de millions d'années après le Big Bang, par accrétion des poussières.
Il y a environ 13 milliards d'années, notre galaxie, la Voie lactée s'est formée.
Il y a un peu moins de 5 milliards d'années, le Soleil s'est formé à son tour et le système solaire avec lui.
2 Les réactions nucléaires au sein des étoiles
C'est dans le coeur des étoiles que des réactions nucléaires vont créer de nouveaux éléments chimiques
1 - la fusion nucléaire
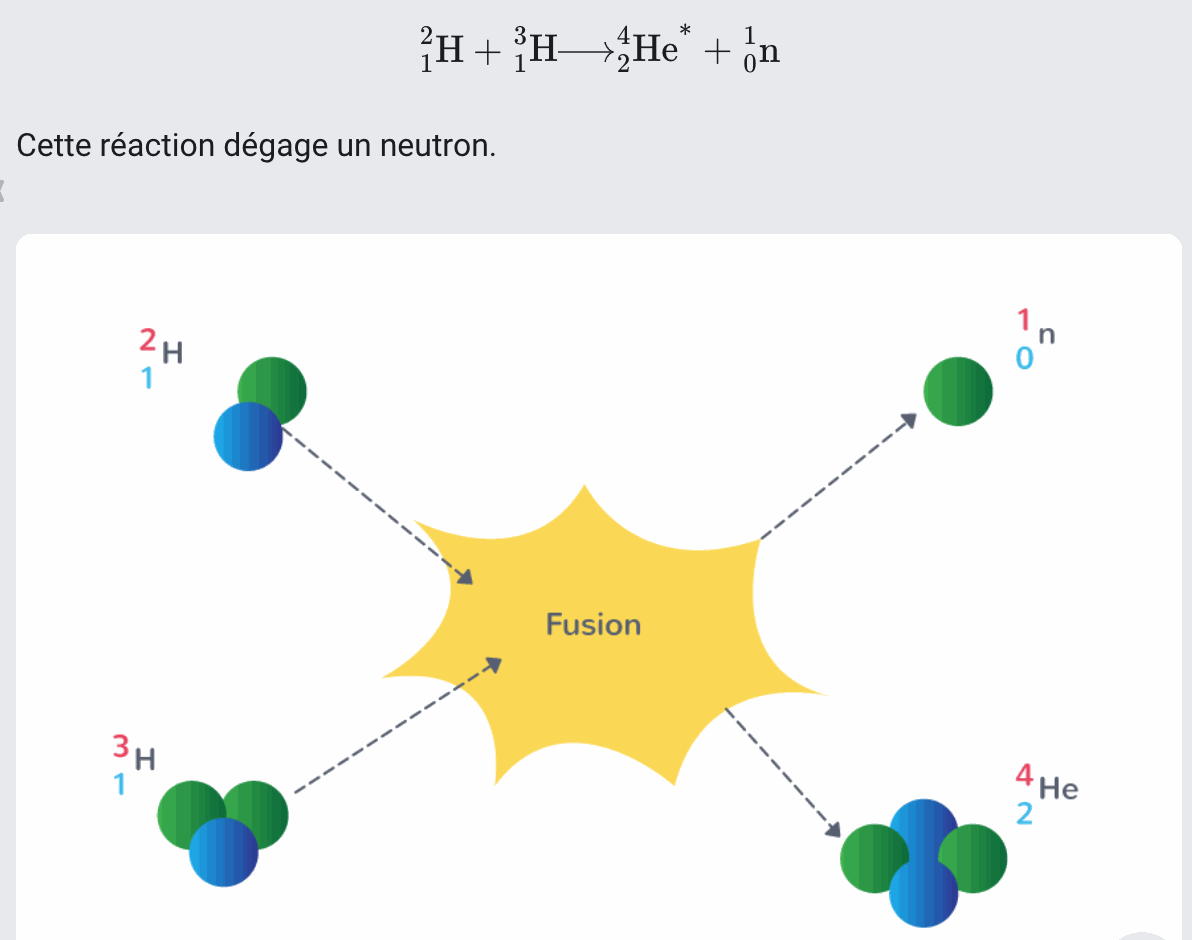
Au sein des étoiles, la pression et la température sont assez élevées pour que des réactions de fusion entre des atomes aient lieu. Elles créent de nouveaux éléments chimiques
Définition Fusion
La fusion est une réaction nucléaire au cours de laquelle deux noyaux atomiques s'assemblent pour former un noyau plus lourd.
Exemple chaque seconde, le soleil transforme 600 millions de tonnes d'hydrogène, ou de ses isotopes, en hélium. Le deutérium (2-1) H et le tritium (3-1) H peuvent notamment fusionner ensemble pour donner de l'hélium |
Propriété
Les fusions nucléaires qui ont lieu dans les étoiles produisent, à partir de l'hydrogène et de l'hélium, les éléments chimiques de numéro atomique Z inférieur ou égal à 26 (le numéro atomique du fer, trop stable pour être le résultat d'une fusion nucléaire).
On désigne ce phénomène par l'expression "nucléosynthèse stellaire"
Au moment de la mort d'une étoile, les noyaux de numéro atomique supérieur à 26 (donc plus lourds que le fer ) sont formés. L'ensemble de ces éléments chimiques sont alors dispersés, enrichissant l'Univers.
Exemple - le carbone Z = 6, l'azote Z = 7 et l'oxygène Z = 8, qui sont les composants majoritaires des êtres humains sont formés au sein des étoiles. - l'uranium Z = 92 est formé lors de l'effondrement de l'étoile |
2 - La fission nucléaire
Avec la fission nucléaire, les hommes produisent de l'énergie et forment des éléments chimiques à partir des noyaux
Définition Fission
La fission est une réaction nucléaire au bout de laquelle l'impact d'un neutron sur un noyau lourd provoque son éclatement en 2 noyaux plus légers.

C - La désintégration et la datation des éléments chimiques
Les noyaux possèdent des isotopes dont certains ne sont pas stables et se désintègrent spontanément avec le temps. Ces noyaux radioactifs sont utilisés dans de nombreux cas, comme par exemple la datation d'objets anciens.
La désintégration des noyaux radioactifs
Parmi les isotopes d'un élément chimique, seuls certains isotopes sont stables. Les autres se désintègrent spontanément : ils sont radioactifs.
Définition Isotope
Deux atomes sont isotopes s'ils ont :
le même numéro atomique Z : ils correspondent donc au même élément chimique et ont les mêmes propriétés chimiques
un nombre de masse A différent : leur noyau ne contient pas le même nombre de neutrons et leur masse est différente.
Définition Radioactivité
la radioactivité est le phénomène associé à la désintégration spontanée des noyaux instable.

propriété
La radioactivité est un phénomène :
spontané : elle se déclenche sans intervention extérieure
aléatoire : on ne peut prévoir l'instant de la désintégration
inéluctable : un noyau instable se désintégrera tôt ou tard
indépendant de la pression et de la température.
Définition Désintégration radioactive
La désintégration radioactive est une réaction nucléaire spontanée au cours de laquelle un noyau radioactif donne naissance à un noyau plus stable
propriété

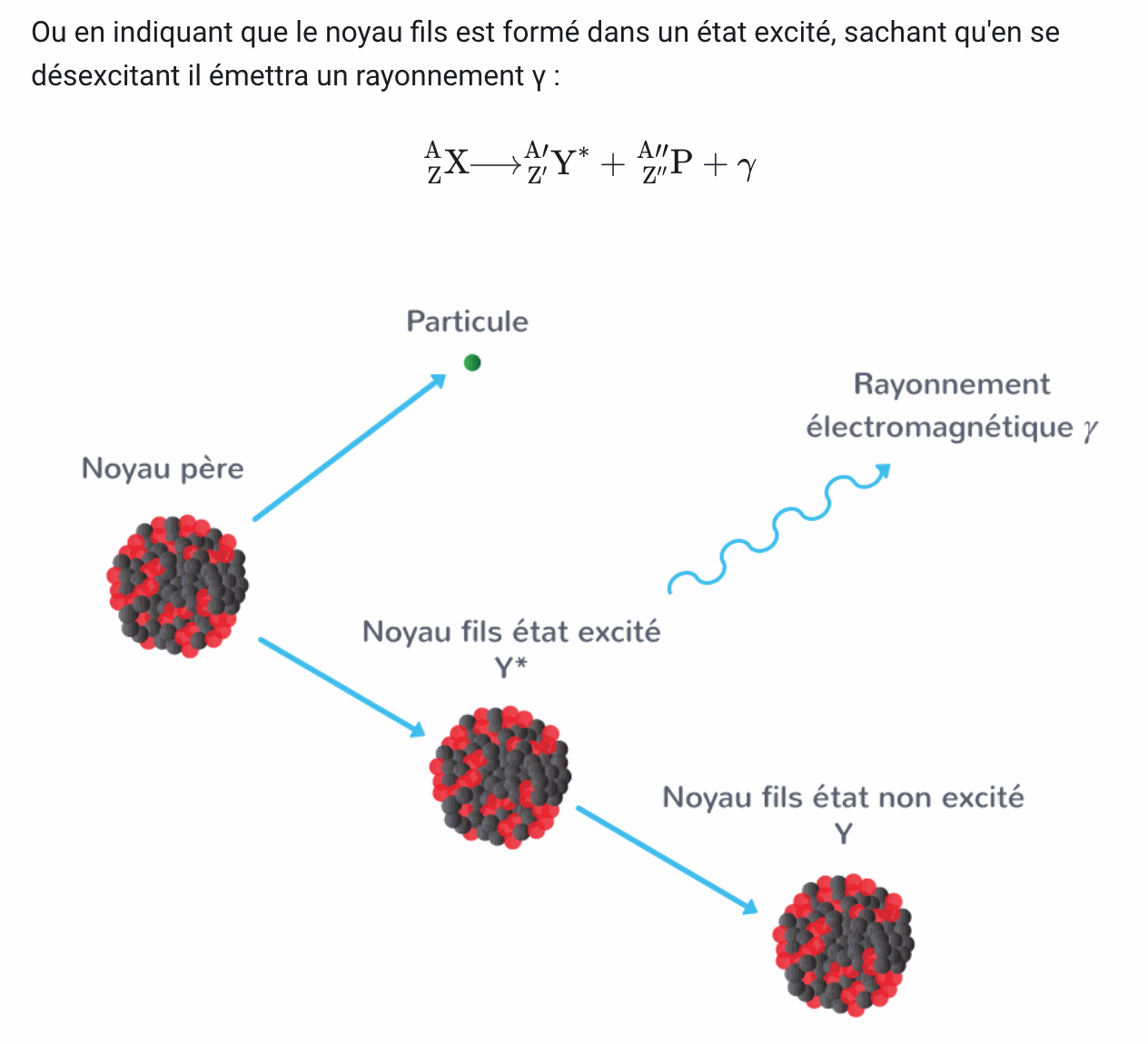
Lors d'une désintégration nucléaire il y a conservation du nombre de charge Z et du nombre de masse A (nombre de nucléons)
Lois de Soddy
Les lois de Soddy permettent d'écrire
D'après la loi de conservation du nombre de masse A = A' + A"
D'après la loi de conservation du nombre de charge Z = Z' + Z"

La demi vie des noyaux radioactifs
Les noyaux radioactifs se désintégrant, leur nombre dans un échantillon diminue continuellement
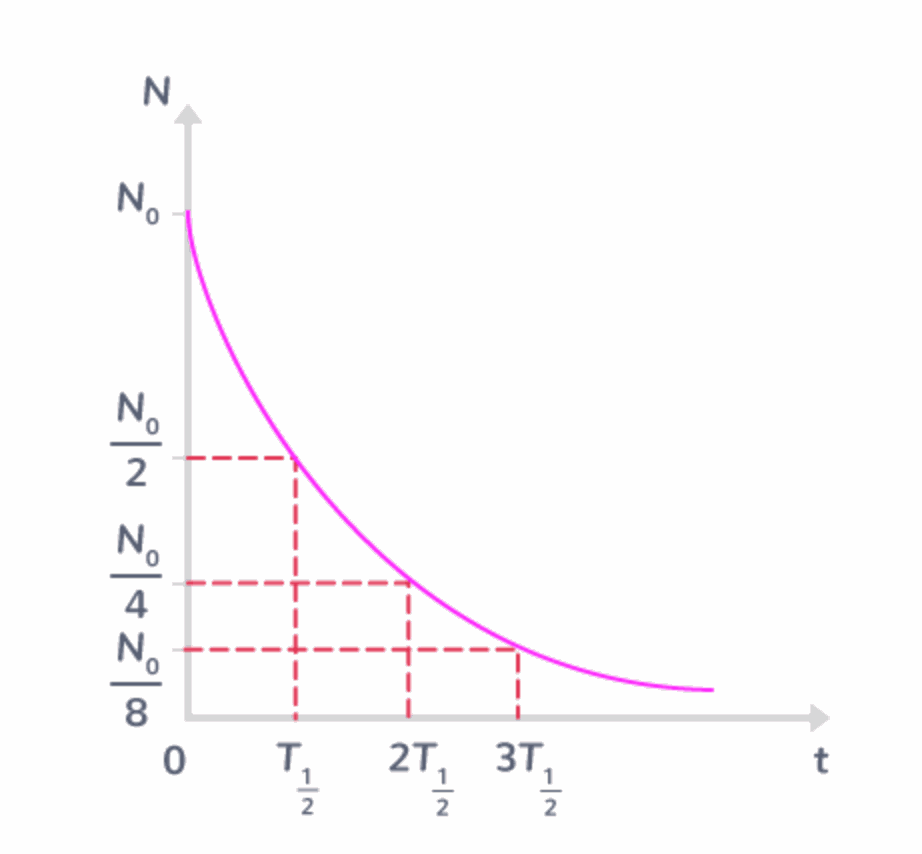
Définition demi-vie
La demi-vie ou période radioactive notée T 1/2 est la durée au bout de laquelle le nombre de noyaux radioactifs contenus initialement dans un échantillon de matière est divisé par 2
Exemple la demi-vie du carbone 14 est 5730 ans
Propriété
Bien qu'il soit impossible de connaitre le moment où un noyau radioactif va se désintégrer on peut prévoir l'évolution d'un grand nombre de noyaux radioactifs à l'aide de leur demi-vie
Dans un échantillon contenant initialement No de noyaux radioactifs, au bout d'une durée t = nx T 1/2 le nombre de noyaux radioactifs encore présents dans un échantillon est N = No / 2 ^n
Le graphique représentant le nombre N de noyaux radioactifs en fonction du temps t est le suivant :

Exemple
une durée de 22 920 ans représente 4 demi-vies du carbone 14
22 920 = 4x5730
Par conséquent au bout de cette durée, le nombre de noyaux de carbone 14 initialement présents dans un échantillon aura été divisé par 2^4. = 16.
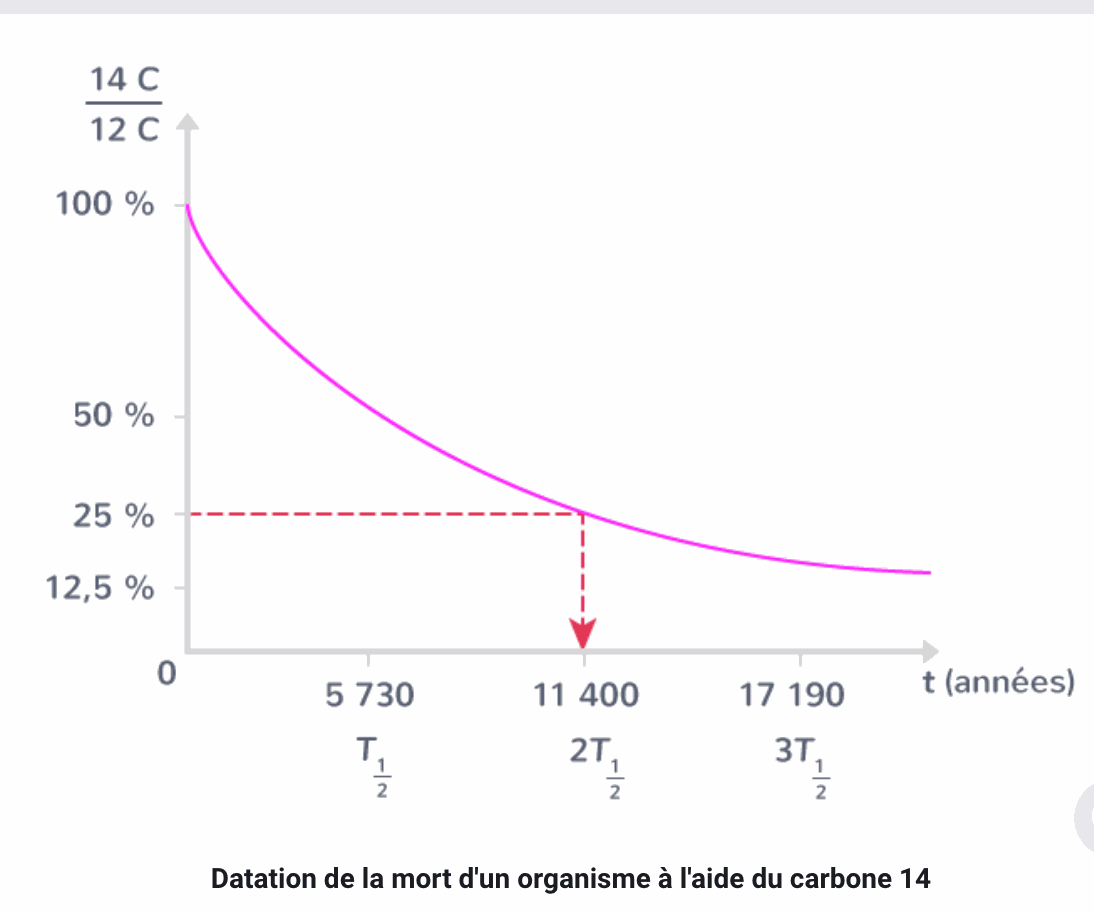
La datation du carbone 14
La demi vie des noyaux radioactifs est utilisée pour dater les éléments chimiques c'est le principe de la datation au carbone 14
propriété
Tant qu'il est vivant, un végétal ou un animal possède un taux de carbone 14 constant lié à celui de l'environnement. Or de ces deux atomes seul le carbone 14 est radioactif.
Quand l'organisme meurt, les atomes de carbone 14 se désintègrent et le rapport du nombre d'atomes de carbone 14 sur le nombre de carbone 12 diminue.
La mesure de ce taux (noté 14C/12C) et la courbe de décroissance exponentielle de ce taux permettent de dater la mort d'un organisme
Exemple :
Sur une mesure dans un organisme mort un taux 14C/12C = 25%
En respectant ce taux sur la courbe de décroissance exponentielle du taux de carbone 14/carbone 12, on peut lire la durée qui sépare la mesure de ce taux de la mort de l'organisme.

Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.