ST2S1ere Ch1/2-Les solutions aqueuses acides, basiques et neutres
1ère Prévenir et Sécuriser
Ajouter à mes favoris
|
Notions et contenus
|
Connaissances et capacités exigibles
Activités expérimentales supports de la formation
|
Comment peut-on utiliser les produits ménagers acides ou basiques en toute sécurité ?
|
Quantité de matière, relation entre masse et quantité de matière
Soluté et solvant Concentration massique Cm et concentration molaire C d'un soluté en solution pH d'une solution aquatique [H3O + ] = 10-pH Mesure du pH d'une solution aquatique |
Calculer une masse molaire M. Connaître et utiliser la relation n = m/M. Définir un soluté, un solvant et une solution. Connaître et utiliser les relations n = C × V et m = Cm × V. Proposer et/ou mettre en œuvre un protocole de dissolution et de dilution pour préparer une solution de concentration molaire ou de concentration massive donnée en soluté moléculaire ou ionique.
Connaître et utiliser la relation [H3O + ] = 10-pH. Définir le caractère neutre, acide ou basique d'une solution aqueuse en termes de pH. Proposer et/ou mettre en œuvre un protocole expérimental pour mesurer le pH d'une solution aqueuse.
|
|
Dans cette partie nous allons étudier :
- Ch 1 - les solutions aqueuses acides, basiques et neutres - Ch 2 - les acides et les bases |
Chapitre 1 Les solutions aqueuses acides, basiques et neutres
Rappels
une solution aqueuse - solvant - soluté
une quantité de matière - mole - densité concentration - molaire
formule brute
I - Quelles sont les grandeurs usuelles en chimie ?
1 - Activité documentaire : Quantité de matière, masse et masse molaire

Lire les documents de la page 10 et répondre aux questions

|
La masse molaire d'un
atome ou d'un ion monoatomique
est
M = mx Na |
La masse molaire d'un
composé moléculaire ou ionique
M = somme des masses molaires des atomes constituant le composé
|
Applications
Exercices 1à 3 page 18
2 - Activité expérimentale : Préparation d'une solution aqueuse par dissolution d'un soluté



Lire les documents de la page 11 et répondre aux questions
Réalisation et schéma du protocole de la dissolution ci-contre
Candidatures :
exercices 4 à 7 page 18
3 - Activité expérimentale : Préparation d'une solution aqueuse par dilution d'une solution mère
Documents page 12 et répondre aux questions
Réalisation et schéma du protocole de la dissolution ci-contre
Le facteur de dilution est défini par F = C0/C1 = V1/V0
Candidatures :
exercices 8 à 10 page 19
|
Résumé de cours
|
La quantité de matière
1. Une nouvelle unité pour compter : la mole
La quantité d'entités chimiques (atomes, ions ou molécules) présente dans un objet est considérable. Les chimistes préfèrent les compter par « paquets », appellent moles.
2. Qu'est-ce que la quantité de matière ?
► La quantité de matière d'un échantillon est le nombre de moles d'entités chimiques (atome, ion ou molécule) contenu dans cet échantillon. Elle est notée n et s'exprime en mole (symbole mol).
► Par définition, une mole d’entités chimiques contient 6,02×1023 entités chimiques. Ce nombre est appelé constante d’Avogadro notée NA : NA = 6,02×1023 mol-1 Exemples : 1 mol d’atomes de fer contient 6,02×1023 atomes de fer et 1 mol de molécules d’eau contient 6,02×1023 molécules d’eau.
3. Les masses molaires
a. Qu’est-ce que la masse molaire atomique ?
► La masse molaire atomique d’un élément est la masse d’une mole d’atomes de cet élément. Elle est notée M et s’exprime en g.mol-1.
► Les masses molaires atomiques sont indiquées dans la classification périodique des éléments.
b. Qu’est-ce que la masse molaire moléculaire ?
► La masse molaire moléculaire est la masse d’une mole de molécules identiques. Elle est notée M et s’exprime en g.mol-1.
► Elle est égale à la somme des masses molaires atomiques des atomes qui la constituent.
Exemples : La masse molaire moléculaire de la molécule d’eau H2O est : M(H2O) = 2×M(H) + M(O) =2×1,0 + 16,0 = 18,0 g.mol-1
NB : La masse des électrons étant négligeable, la masse molaire d’un ion est égale à celle du (des) atome(s) le constituant.
M(Cu2+) = M(Cu) et M(SO4 2-) = M(S) + 4 × M(O).
4. Quelle relation existe-t-il entre la masse et la quantité de matière ?
► La quantité de matière n d’un échantillon de masse m et de masse molaire M est telle que :
n = m/M ou m = n x M, avec m en g , M en g.mol-1 et n en mol
Les solutions aqueuses
1. Un peu de vocabulaire
► Une solution est obtenue en dissolvant une (ou plusieurs) espèce(s) chimique(s) appelé soluté dans un liquide appelé solvant.
Lorsque le solvant est l’eau, on parle de solution aqueuse.
► Le soluté peut-être un solide (sucre dans le café, sulfate de cuivre…),
- un liquide (alcool dans l’eau, …)
- ou un gaz (dioxyde de carbone dissous dans les boissons, dioxygène dans l’eau, …).
► Si le soluté est constitué d’ions (molécules), on obtient une solution ionique (moléculaire).
► Quand le soluté est en trop grande quantité par rapport au volume de solvant, la solution peut être saturée en soluté.
2. Qu’est-ce que la concentration d’une solution ?
a. La concentration massique
La concentration massique Cm d’une espèce chimique dans une solution est la masse m du soluté dissous dans un volume V de solution.
Elle s’exprime en g/L.
Cm = m / V avec m en g , V en L et Cm en g.L-1
b. La concentration molaire
La concentration molaire C d’une espèce chimique dans une solution est la quantité de matière n du soluté dissous dans un volume V de solution.
Elle s’exprime en mol/L.
C = n / V = avec n en mol , V en L et C en mol.L-1
c. Quelle est la relation entre les deux concentrations ?
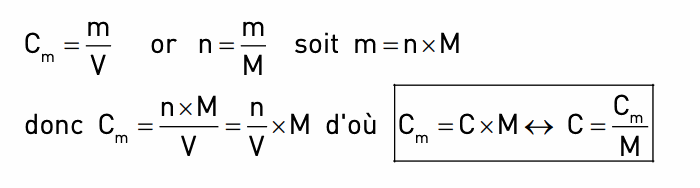
3. Comment préparer une solution de concentration donnée ?
a. Par dissolution
On détermine la masse m de soluté à peser que l’on doit dissoudre dans le volume V de solution.
• A partir de la concentration massique Cm : m = Cm × V
• A partir de la concentration molaire C : n = C x V or n = m / M soit m = C x V x M
b. Par dilution
► On prélève un petit volume V1 d’une solution mère 1 de concentration connue auquel on ajoute de l’eau pour obtenir un volume V2 d’une solution fille 2 de concentration plus faible.
► Lors de la dilution, il y a conservation de la masse et de la quantité de matière en soluté apporté : La masse ou la quantité de matière de soluté dans le volume V1 de solution mère prélevé est la même que dans le volume V2 de solution fille obtenu.
• Avec la concentration massique : m1 = m2 soit Cm1 × V1 = Cm2 × V2
• Avec la concentration molaire : n1 = n2 soit C1 × V1 = C2 × V2
► On peut aussi calculer le facteur de dilution f où f est un nombre sans unité toujours supérieur à 1.
f = Cm1 / Cm2 ou C1 /C2 et donc f = V2 / V1
Exemples : Quand on souhaite diluer trois fois une solution d’eau salée, il faut prendre un volume d’eau salée et le double d’eau distillée ; quatre fois une solution d’eau salée en prenant un volume d’eau salée pour trois volumes d’eau distillée. Toute solution se prépare en utilisant une fiole jaugée et les prélèvements de volume se font à l’aide de pipette(s) jaugée(s) pour une meilleure précision.
Devoir N°1 sur table le 27/09/21
------- Suite --------
2ième partie : Le pH des solutions aqueuses
1. Définition du pH d’une solution et échelle de pH
Les propriétés acides d’une solution aqueuse peuvent être mises en évidence par la mesure d’une grandeur physique appelée pH, « potentiel Hydrogène ».
La relation entre le pH d’une solution aqueuse et la concentration en ions oxonium H3O+
(notée [H3O+] et exprimée en mol.L-1) :
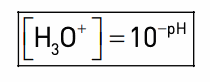
Le pH est une grandeur positive (entière ou décimale) et sans dimension (sans unité).
Exemple : si pH = 2,0 alors [H3O+] = 10 puissance (-2,0 )= 1,0.10 puissance (-2) mol.L-1
Nous en déduisons les conditions pour lesquelles une solution est dite acide, neutre ou basique :

Dans notre quotidien, nous retrouvons bon nombre d’acides et de bases :
- acide chlorhydrique (présent dans notre estomac) de formule HCl
- acide éthanoïque (présent dans le vinaigre) de formule CH3COOH
- acide sulfurique (présent dans les batteries de voiture) : H2SO4
- soude (ou hydroxyde de sodium) : NaOH
- ammoniac : NH3
2. Mesure du pH d’une solution
La mesure du pH d’une solution peut se faire par trois méthodes de précision différente.
a. L’indicateur coloré
Un indicateur coloré est une substance qui change de couleur selon la valeur du pH. Il se présente généralement sous forme d’une solution.
On donne ci-dessous la couleur de chacun des deux indicateurs colorés en solution aqueuse :
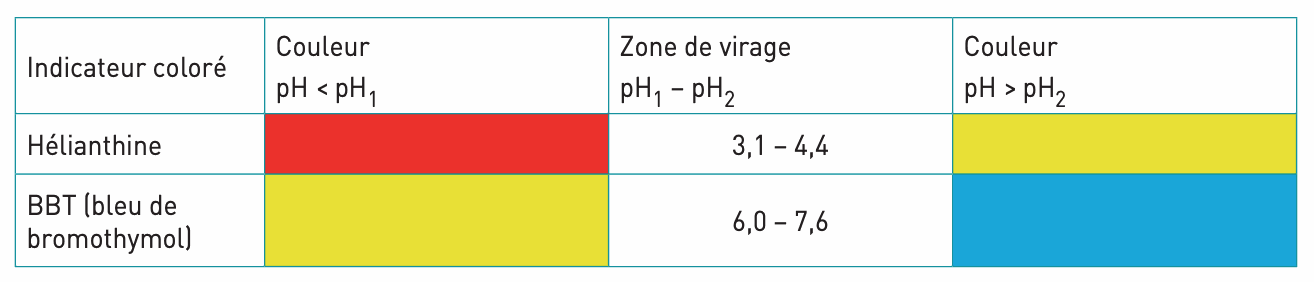
Pour mesurer le pH d’une solution à l’aide d’un indicateur coloré, il suffit d’en ajouter quelques gouttes dans la solution et d’observer la couleur que prend la solution.
Cette méthode est évidemment peu précise ; les indicateurs colorés sont plutôt utilisés lors des dosages acido-basiques.
b. Le papier indicateur de pH
La mesure du pH d’une solution aqueuse (qui nous permettra de savoir si la solution est acide ou non) peut se faire à l’aide d’un papier indicateur de pH, papier imbibé d’un mélange d’indicateurs colorés puis séché.
Le fait de déposer une goutte de solution sur ce papier lui fait prendre une couleur que l’on compare aux couleurs étalons sur la boîte. Méthode plus précise que la précédente : les valeurs de pH correspondant aux couleurs étalons indique une valeur de pH à une unité près (voire 0,5 unité près).
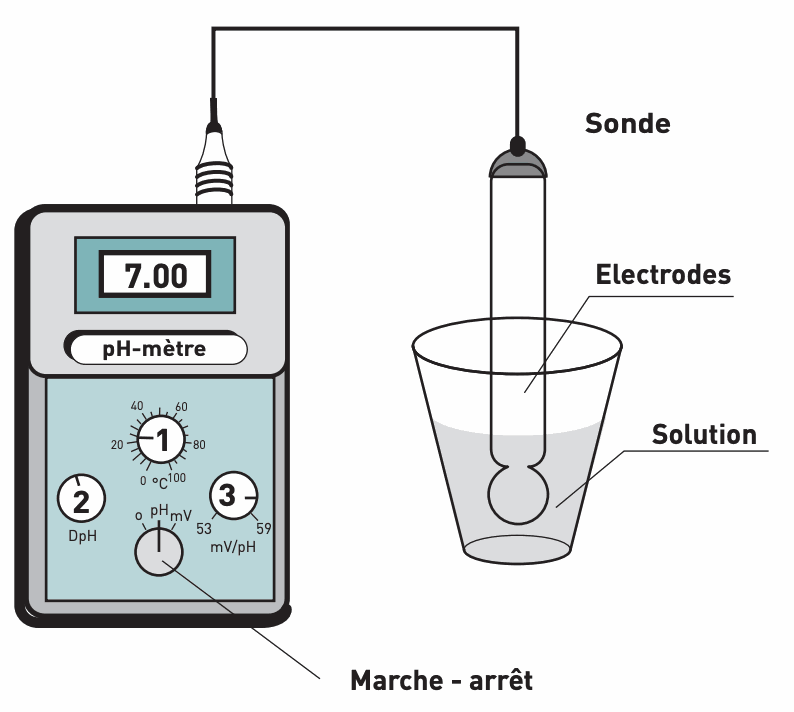
c. Le pH-mètre
Un pH-mètre est un voltmètre qui mesure la tension électrique (ou différence de potentiels électriques) existant entre ses deux bornes appelées ici électrodes, et qui transforme ce résultat en valeur de pH.
Un pH-mètre possède :
• un boîtier électronique contenant le voltmètre.
• une électrode de référence dont le potentiel électrique est constant.
• une électrode de mesure dont le potentiel électrique est fonction affine du pH.
Ch 2 Les acides et les bases
|
Notions et contenus
|
Connaissances et capacités exigibles
Activités expérimentales supports de la formation |
|
Acide, base, couple acide/base, réaction acido-basique
Échelles d’acidité et de basicité, solution aqueuse acide, basique, neutre Autoprotolyse de l’eau, produit ionique de l’eau, concentrations molaires [H3O + ] et [HO- ] Pictogrammes de sécurité Règles de sécurité chimique relatives aux acides et bases |
Définir un acide et une base selon Brönsted. Écrire l’équation d’une réaction acido-basique à partir des couples acide/base. Connaître le nom usuel et les formules des acides et des bases les plus courants : acide chlorhydrique, acide éthanoïque, acide sulfurique, soude, ammoniac. Écrire l’équation de la réaction d’autoprotolyse de l’eau. Utiliser, sans calcul, l’expression du produit ionique de l’eau pour relier qualitativement les concentrations [H3O + ] et [HO- ]. Proposer et/ou mettre en œuvre un protocole de classement de produits ménagers selon leur acidité. Connaître la signification des pictogrammes de sécurité. Appliquer les règles de sécurité liées à l’usage des solutions acides et basiques concentrées, et à leur mélange. Connaître les gestes de secours en cas de projection d’acide ou de base. Dans le cadre de la gestion des déchets, mettre en œuvre un protocole de neutralisation d’une solution acide par une solution basique ou inversement. |
1 - Un acide, une base, comment les définir ?
Selon le chimiste danois Joannes Brönsted (1879-1947), voici comment on les définit :
- Un acide est une espèce chimique capable de céder au moins un proton H+.
Ce transfert de proton s’écrit HA → A- + H+
- Une base est une espèce chimique capable de capter au moins un proton H+.
Ce transfert de proton s’écrit A- + H+ → HA
Nous avons ici un couple acide / base : HA / A
Exemples :
1. Une molécule d’acide éthanoïque de formule CH3 COOH cède un proton H+ à un ion hydroxyde HO- pour former l’ion éthanoate CH3-COO- et une molécule d’eau H2O :
CH3-COOH + HO- → CH3-COO- + H2O
Dans cette équation, nous distinguons deux couples acide / base : CH3COOH / CH3COO- et H2O / HO-.
2. L’ammoniac NH3 fait partie du couple NH4 + / NH3. Sa réaction avec des ions oxonium H3O+ du couple H3O+ / H2O a pour équation :
NH3 + H3O+ → NH4 + + H2O
Lors d’une réaction acidobasique, nous avons donc un échange de protons entre un acide d’un premier couple acide / base et une base d’un second couple .
2 - Le cas de l’autoprotolyse de l’eau
L’eau fait partie de deux couples acide / base distincts :
- en qualité d’ acide dans le couple H2O / HO-
- en qualité de base dans le couple H3O+ / H2O
Deux molécules d’eau peuvent donc réagir suivant l’équation d’autoprotolyse :
H2O + H2O ⇆ HO- + H3O+
Sachant que le pH d’une eau, considérée pure, serait de 7,0, nous pouvons en déduire les concentrations des oxonium H3O+ et des ions hydroxyde HO- :
• [H3O+] = 10 puissance -pH = 10 puissance -7,0 = 1,0.10-7 mol.L-1
• Le pH étant neutre : [HO-] = [H3O+] = 1,0.10-7 mol.L-1
Ces deux concentrations sont très faibles.
Dans toute solution aqueuse, quel que soit le pH, le produit des concentrations en ions H3O+ et en ions HO- est une constante, dénommée produit ionique de l’eau et a pour expression :
Ke = [H3O+] [HO-] = 1,0x10-14 à T = 25 °C
Le produit ionique de l’eau est sans dimension (sans unité).
Qualitativement, nous pouvons en déduire que lorsque la concentration d’un des deux ions (H3O+ ou HO-) diminue, l’autre augmente, et réciproquement.
Règles de sécurité chimique relatives aux acides et aux bases
Tout acide et toute base, de concentration élevée, a sur son étiquette un pictogramme de sécurité mentionnant sa dangerosité (c’est corrosif) comme ci-dessous :
Il faut donc porter blouse, lunettes et gants lors de la manipulation d’acides et de bases concentrés.
Lors de réaction chimique les mettant en jeu, des risques de projection sont à craindre en raison d’une très forte probabilité d’élévation de la température. En cas de projection, il faut de suite rincer abondamment à l’eau sans frotter et appeler les urgences au plus vite ( tél. 15 en France ).
L’Institut national de recherche et de sécurité pour la prévention des accidents du travail et des maladies professionnelles (I.N.R.S.) dispose d’un site internet ( http://www.inrs.fr ) permettant de se tenir informé(e) concernant tous les risques qu’ils soient chimiques ou de toute autre nature.
lire les documents page 13 et répondre aux questions
mesures du pH des solutions
Candidatures :
exercices 11 à 13 page 19
bon courage !

Laisser un commentaire
Vous devez être Connecté en tant que pour poster un commentaire.